SARCOMAS
DE TEJIDOS BLANDOS EN TRONCO Y EXTREMIDADES
Epidemiología
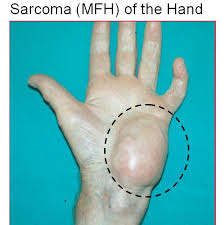
Los sarcomas constituyen menos de 1% de los tumores sólidos del
adulto. En el año 2003, en México se registraron 1 804 casos (1.64/100 000 habitantes)
y 493 defunciones (0.8% del total de muertes por causas malignas). 1 Aunque
existe un pico de máxima incidencia durante la infancia debido a los
rabdomiosarcomas embrionarios, en general estos tumores son más comunes en
individuos mayores de 50 años (hasta 40% en personas de 55 años o más). No
existe una aparente predisposición racial o por sexo. Los sarcomas pueden
ocurrir en cualquier sitio del cuerpo, pero la mayoría se origina en las
extremidades (59%), tronco (19%), retroperitoneo (15%) y cabeza y cuello (19%).
Se han descrito más de 50 tipos histológicos de tejidos blandos, pero los más
frecuentes son histiocitoma fibroso maligno (28%), leiomiosarcoma (12%),
liposarcoma (15%), sarcoma sinovial (5%), tumor maligno de la vaina nerviosa
periférica (6%) y el rabdomiosarcoma, que es el tumor más frecuente en niños. Etiología La mayoría de los casos no tiene un agente causal
identificable, aunque hay múltiples factores concomitantes. Datos recientes
sugieren que ciertas mutaciones adquiridas en las células madre
pluripotenciales mesenquimatosas dan lugar a clonas malignas que se diferencian
por vías que semejan la histogénesis normal. En una importante proporción de
sarcomas se detectan alteraciones en los genes RB, p-53 y NF-1, así como
sobreexpresión de receptores para factores de crecimiento como PDGF-R y EGF-R,
y mutaciones de los oncogenes myc y ras. En los análisis citogenéticos de los tumores de
tejidos blandos se han identificado diferentes translocaciones cromosómicas que
codifican para oncoproteínas relacionadas con ciertos subtipos histológicos. Los
genes mutados y mejor caracterizados se han encontrado en sarcomas de Ewing
(fusión EWS-FLI-1), sarcoma de células claras (fusión EWS-ATF- 1), liposarcoma
mixoide (fusión TLS-CHOP), rabdomiosarcoma alveolar (fusión PAX3-FHKR), tumor
desmoplásico de células pequeñas y redondas (fusión EWS-WT1) y sarcoma sinovial
(fusión SSX-SYT). Factores de riesgo Algunos factores que predisponen el desarrollo de sarcomas de
partes blandas son los antecedentes familiares de sarcomas, el síndrome de
Li-Fraume ni, antecedentes de
neurofibromatosis, síndrome de carcinomas basocelulares nevoides, esclerosis
tuberosa, poliposis colónica, exposición a asbestos y herbicidas, antecedentes
de radioterapia, linfedema crónico y ciertos rasgos genéticos (a juzgar por la
amplificación de algunos oncogenes observada en ciertos tumores). El
tratamiento con radioterapia para tumores de mama, cérvix, ovario, testículo o
linfoma aumenta hasta 50 veces la incidencia de sarcomas. Sin embargo, el
riesgo depende de la dosis de radiación; a pesar de todo, la mediana del
periodo de latencia es de 10 años Anatomía patológica y factores del pronóstico La imagen microscópica recuerda con frecuencia las
variedades especializadas del tejido conectivo, como músculos liso y estriado,
hueso, cartílago, membranas sinoviales, pleura, pericardio y endotelio
vascular. De estas semejanzas y ciertas características bioquímicas deriva su
nombre. Aunque los tumores neurógenos se desarrollan a partir de tejidos de
origen ectodérmico, se incluyen en los sarcomas por su conducta biológica
similar y principios de tratamiento. Los tipos histológicos de sarcomas más
comunes en las extremidades son, por frecuencia: histiocitoma fibroso maligno
(28%), liposarcoma (15%), leiomiosarcoma (12%), sarcoma sinovial (10%), tumores
malignos de vaina de nervio periférico (6%), rabdomiosarcoma (5%) y
fibrosarcoma (3%); en el retroperitoneo los más frecuentes son liposarcoma
(50%), leiomiosarcoma (29%) e histiocitoma fibroso maligno y otras variedades histológicas
raras en los casos restantes. Es conveniente la asignación de un tipo
específico porque ello facilita la obtención de información útil, pero su valor
terapéutico es limitado debido a que los principios de tratamiento son
semejantes y sólo se modifican por el conocimiento de factores pronósticos
(como grado y tamaño tumoral). La tendencia a formar metástasis depende del
grado histológico: los tumores de bajo grado tienden a ser agresivos localmente
y poseen menor capacidad metastásica que los tumores de alto grado, en los
cuales las probabilidades de metástasis son mayores, sobre todo por vía
hematógena. Determinar el estadio de los sarcomas deriva de la morfología
celular, presencia de necrosis, morfología nuclear, grado de celularidad,
vascularidad, cantidad de estroma y el número de mitosis, entre otros factores.
Los tumores suelen clasificarse como de grados bajo y alto. También se valora
el tamaño, debido a su importancia pronóstica. Los tumores menores de 5 cm
tienen un porcentaje de control local cercano a 100%. Las diferencias son
marcadas si los tumores se estratifican como mayores o menores de 10 cm, ya que
existe una clara diferencia en la proba
bilidad de obtener márgenes tridimensionales libres y diferencias en cuanto a
la supervivencia. Otros factores pronósticos adversos son localización profunda
de las lesiones y edad mayor de 50 años
Patrones
de diseminación Los
sarcomas se diseminan en forma local siguiendo el trayecto de las fibras musculares,
fascias, nervios y vasos sanguíneos, a veces mucho más allá de los límites
palpables del tumor; esto explica la alta frecuencia de recaída local después
de resecciones limitadas. La diseminación linfática es rara, pero su presencia
indica un pronóstico ominoso. Al momento del diagnóstico, la frecuencia de
ganglios metastásicos, clínicos y subclínicos, es menor de 5%; en cambio,
aumenta para histiocitoma fibroso maligno, sarcoma sinovial, sarcoma de células
claras, sarcoma epitelioide y rabdomiosarcoma. La vía hematógena es la forma más
común de diseminación a distancia. El pulmón es el sitio más afectado (35%),
seguido de hígado (25%), hueso (22%) y cerebro (5%), entre otros. En contraste,
el desarrollo biológico de los sarcomas localizados en el retroperitoneo y en
cabeza y cuello se caracteriza por invasión local y capacidad metastásica
limitada. Los sarcomas de retroperitoneo provocan enfermedad a distancia en 10
a 20% de los casos. Una revisión del Instituto Nacional de Cancerología (datos
no publicados) basada en 91 casos demostró metástasis a distancia a la
presentación en 16% de los pacientes y como recaída de la enfermedad en 22%; de
ellas, 30% ocurrió en el hígado, 30% en pulmón, 10% en tejidos blandos y 15% en
hueso. Las metástasis hepáticas son más frecuentes debido al acceso directo al
sistema porta. Sin embargo, el sitio principal de recaída es el lecho tumoral o
dentro de la cavidad peritoneal (sarcomatosis peritoneal). La recurrencia local
se presenta hasta en 90% de los casos y suele causar la muerte. Sólo un tercio
de los tumores con recurrencia local desarrolla metástasis a distancia.3,4 Estadifi cación La estadificación de los tumores es muy importante porque permite
evaluar el pronóstico, asignar programas de tratamientos multimodales y
comparar los resultados de tratamiento de distintas instituciones y en
diferentes momentos. El sistema de estadificación más usado es el que
desarrolló el AJCC/UICC en 2002 (cuadro 66-1). Los principales componentes de
la nueva estadificación son: grado, tamaño de la lesión y presencia de
metástasis ganglionares o a distancia. La profundidad de la lesión es una nueva
variable, considerada como una categoría dentro del tamaño ganglionar. Una
lesión superficial es aquella que se localiza exclusivamente por encima de la
fascia superficial, sin invadirla. Un tumor profundo es aquel que se encuentra
por debajo o encima de la fascia superficial y la invade; los sarcomas
retroperitoneales, mediastínicos y pélvicos se clasifican como tumores
profundos. Este sistema no se aplica al sarcoma de Kaposi, dermatofibrosarcoma protuberante,
fibrosarcoma grado I (tumor desmoide) ni sarcomas originados en la duramadre,
cerebro, órganos parenquimatosos o vísceras huecas.9,10 Manifestaciones clínicas La manifestación más común es la presencia de un tumor indoloro
con crecimiento progresivo. La aparición temprana de las manifestaciones
depende de la localización. El muslo y retroperitoneo pueden alojar tumores de
10 a 15 cm antes de ser evidentes. En contraste, en la mano y brazo se hacen
evidentes desde que alcanzan los 2 cm; la parrilla torácica y la pared abdominal
representan una situación intermedia. En general, los hallazgos y síntomas se
atribuyen a desgarros musculares, hematomas o abscesos. El diagnóstico
diferencial incluye una variedad de tumores benignos, de los cuales el más
frecuente es el lipoma. La mayoría de los pacientes (62%) con sarcomas
retroperitoneales se presenta a consulta con una masa abdominal, con o sin
dolor concomitante. Hasta un tercio cursa con algún síntoma derivado de la
compresión de raíces nerviosas. Rara vez hay ascitis por obstrucción portal,
obstrucción intestinal, fiebre de bajo grado atribuida a necrosis tumoral,
sangrado de origen intestinal y manifestaciones de obstrucción venosa. Los
tumores muy voluminosos y poco diferenciados pueden causar hipoglucemia debido
a la liberación de sustancias semejantes a la insulina. El diagnóstico
diferencial de los tumores retroperitoneales incluye linfomas y tumores de
células germinales, mas no los tumores que se originan en los órganos
retroperitoneales, como riñón, páncreas o duodeno, y que son malignos en 82 a
85%. Entre los benignos destacan los lipomas y angiomiolipomas; en cuanto a los
malignos, 40% es de linfomas o tumores de células germinales y 55% corresponde
a sarcomas. En cuanto a los sarcomas de la pared abdominal, incluido el tumor
desmoide, se presentan a menudo como tumores asintomáticos o acompañados de
dolor. Deben diferenciarse de los tumores intraabdominales mediante palpaciones
con maniobras que incrementen la tensión de la pared abdominal. Los tumores de
la pared no desaparecen con la tensión. Rara vez existen ganglios linfáticos
metastásicos inguinales o axilares. Los tumores desmoides también son una
manifestación extracolónica del síndrome de Gardner, y en general ocurren en la
pared abdominal, aunque también se
originan dentro del abdomen, el mesenterio o mesocolon, con o sin extensión al
retroperitoneo. El diagnóstico diferencial de cualquier tumor en la pared
abdominal se realiza con lipoma, neurofibroma, hernia, absceso crónico y
hematoma. La afección en la pared torácica debe distinguirse de los tumores
óseos. En este sitio ocurre una variedad de masas benignas y malignas. La
mayoría de los tumores malignos presenta síntomas. La prevalencia de dolor es
mayor entre los tumores óseos, en comparación con las neoplasias originadas en
los tejidos blandos. Diagnóstico y evaluación de la extensión de la enfermedad Ningún signo clínico permite distinguir un tumor de
tejidos blandos benigno de uno maligno. Por ello, cualquier masa merece una
evaluación cuidadosa; la única justificación para obviarla es la existencia del
tumor durante varios años sin ninguna modificación; de lo contrario, es
necesaria la evaluación inicial y radiológica exhaustiva. Si la sospecha de
malignidad es alta, se vuelven necesarios los exámenes de laboratorio
convencionales, incluso tiempos de coagulación y pruebas de función hepática.
Las placas simples son de utilidad limitada; la tomografía por computadora (TC)
y la resonancia magnética nuclear (IRM) son los estudios de imagen más útiles
en la evaluación, ya que permiten determinar la localización exacta del tumor y
sus relaciones anatómicas. La IRM es superior a la TC para distinguir el tejido
tumoral de los tejidos adyacentes normales; además, proporciona imágenes
coronales y sagitales que facilitan la evaluación del tumor en relación con
estructuras nerviosas y vasculares, con lo que se llega a una mejor planeación
de la resección quirúrgica. La administración de gadolinio combinada con imagen
dinámica mejora la localización del tumor y la definición de sus
características. Sin embargo, la TC helicoidal es preferible para examinar los
sarcomas de tórax, retroperitoneo y abdomen, ya que la interfaz aire/tejido y
los artefactos de movimiento degradan la imagen. La administración de medio de
contraste oral facilita la distinción de los tumores intraabdominales; además,
la TC es más sensible en la evaluación del compromiso óseo. Los linfomas
retroperitoneales se muestran como una masa central multinodular. El
diagnóstico clínico se apoya en la presencia de síntomas y la elevación sérica
de LDH. Los tumores de células germinales suelen ser homogéneos y los
marcadores tumorales están elevados. Los sarcomas se muestran como masas
heterogéneas debido a la presencia de necrosis. Los sarcomas retroperitoneales
también deben distinguirse de tumores como carcinomas renales o suprarrenales. En los sarcomas de alto grado, sobre todo si son mayores de 5
cm, está indicada durante la evaluación inicial una TC de tórax con ventana
para parénquima pulmonar, con el fin de excluir metástasis, las cuales podrían modificar
el enfoque terapéutico; además, la TC sirve de base para comparaciones futuras.
La radiografía simple es muy específica pero poco sensible (hasta 20% de las
metástasis son ignoradas por la poca fidelidad del estudio); la tomografía es
más sensible pero menos específica; por lo tanto, la combinación de ambas
favorece una evaluación más exacta. Aun así, cuando se detecta afección
unilateral, 43% de los casos presenta metástasis bilaterales al momento de la
resección. Cuando se sospechan metástasis óseas o cerebrales, se indica
centellografía ósea o TC del cráneo. El diagnóstico definitivo se establece
mediante biopsia, de preferencia después de los estudios de imagen
correspondientes. Las técnicas para biopsias son las siguientes: 1. Biopsia por aspiración con aguja
fina (BAAF). Debido al
tamaño limitado de las muestras, el diagnóstico suele ser impreciso. No se recomienda
para el diagnóstico primario, sino más bien para corroborar recaídas. 2. Biopsia con aguja cortante
(tru-cut). Se indica en
sitios con experiencia, ya que la muestra es pequeña y poco representativa.
Está contraindicada en sarcomas retroperitoneales porque causa contaminación y
sarcomatosis posterior, pero puede ser muy útil en grandes tumores profundos de
la pelvis o área paraespinal debido a que la contaminación de los planos
titulares es mínima y puede proveer información suficiente para evitar una
biopsia quirúrgica abierta. 3. Biopsia
incisional. Es el
procedimiento diagnóstico más común y se realiza sobre todo en tumores mayores
de 5 cm de diámetro. La localización de la incisión debe considerar el
tratamiento definitivo y de preferencia debe ser practicada por el cirujano que
se encargará del tratamiento definitivo. 4. Biopsia excisional. Se
indica en tumores pequeños (de 3 cm de diámetro) y localización superficial
(cutáneos o subcutáneos), en los cuales la reescisión, de ser necesaria, no
causaría ningún problema. Bajo ninguna circunstancia se debe enuclear el tumor.
Es muy importante que la biopsia se realice en el centro donde se atenderá al paciente de forma
definitiva. Esto facilita la
ubicación apropiada de la incisión y evita dificultades diagnósticas que se
presentan en centros con poca experiencia. La biopsia se realiza mediante una
incisión longitudinal en el mismo eje de las extremidades y en el sitio más prominente,
de forma que la cica triz se incluya con facilidad en la escisión definitiva.
La hemostasia debe ser rigurosa y deben evitarse los drenes; si fueran
necesarios, se exteriorizan a través de la herida principal. La biopsia típica
proporciona tejido suficiente (1 a 2 cm3) para determinar el tipo histológico y
el grado tumoral, apoyados en la realización de un panel de inmunohistoquímica
(fig. 66-1).12,13 El estudio transoperatorio de una biopsia incisional sólo se
realiza cuando un tumor retroperitoneal se considera irresecable o se contempla
la posibilidad de un tumor germinal o linfoma. El diagnóstico diferencial de
los sarcomas puede ser un reto para el patólogo. Con frecuencia, para
establecer el diagnóstico preciso se requieren estudios de inmunohistoquímica
(vimentina, desmina, actina, leu-7, antígeno de membrana epitelial, queratina,
S-100, antígeno de factor VII y mioglobina, por mencionar algunos),
citogenética y de microscopia electrónica. Un grupo significativo de pacientes,
sobre todo niños y adultos jóvenes, así como la mayoría de los tumores
adipocíticos, se caracteriza por aberraciones cromosómicas específicas, casi
todas translocaciones recíprocas que pueden tener utilidad diagnóstica y a
veces pronóstica. Si no se puede hacer un reconocimiento de cariotipo, son muy
útiles las técnicas de genética molecular, como reacción en cadena de la
polimerasa de transcripción inversa e hibridación in situ con fluorescencia; sin embargo, incluso los centros
especializados no pueden clasificar 5 a 10% de los casos Tratamiento Principios quirúrgicos El tratamiento primario de los sarcomas en partes
blandas es la resección con un margen tridimensional negativo. Sin embargo, su
extensión y su óptima combinación con radioterapia pueden ser objetos de
controversia. Si se considera la radicalidad, las resecciones se clasifican de
la manera siguiente: • Resección intralesional: el plano de disección discurre
a través de la seudocápsula de la neoplasia dentro de la lesión; aunque el
tumor macroscópico se mantiene intacto, el campo operatorio se considera contaminado.
• Resección marginal: el plano de disección pasa a través de la zona reactiva,
inmediatamente por fuera de la lesión macroscópica; por lo tanto, deja
enfermedad residual microscópica. • Resección amplia: incluye la resección del
tumor completo, de la zona reactiva y un margen de 2 a 3 cm de tejido normal,
pero no de la estructura que origina el tumor; puede haber tumor residual microscópico.
• Resección radical: se extirpan el tumor completo y la estructura de origen de
la lesión. El plano de disección sobrepasa la fascia limítrofe. No hay tumor
residual. Aunque resulta obvio que los dos últimos tipos ofrecen el mejor
control local, en la práctica no siempre son aceptables debido a las secuelas
funcionales y estéticas o a la proximidad de estructuras vitales. En la
práctica suelen lograrse resecciones con amplios márgenes en ciertas áreas y
con márgenes limitados en otras. Un sarcoma que invade o hace contacto con una estructura
neurovascular importante o un hueso puede requerir el sacrificio inaceptable de
esa estructura si es que se pretende lograr un amplio margen. La conservación
del órgano debido a su función puede incrementar el riesgo de recaída local,
aunque éste puede reducirse con tratamiento coadyuvante. Sarcomas en las
extremidades El
objetivo del tratamiento quirúrgico es mejorar el control local a fin de optimar
el resultado funcional. En el plan quirúrgico deben considerarse: el tamaño del
tumor, su localización, el grado, tipo histológico, tratamientos previos, edad,
estado funcional del paciente y el grado de la pérdida funcional debido a la
resección. Las amputaciones y desarticulaciones se recomiendan cuando otros
procedimientos no logran el control local ni la conservación de una extremidad funcional.
Aunque algunos centros europeos logran conservar la extremidad en 90% de los
casos con buenos resultados oncológicos y funcionales, hay que tomar en cuenta
que los tumores observados en Estados Unidos y Europa son de menor tamaño que
los reportados por países como México. En casos seleccionados, la combinación
de una operación conservadora de la extremidad seguida de radioterapia
(braquiterapia, teleterapia o radioterapia intraoperatoria) permite el buen
control local y tiene óptimos resultados funcionales.14,15 La resección
como tratamiento único sólo se aplica a tumores pequeños, menores de 5 cm,
sobre todo de bajo grado y que pueden extirparse completos, con al menos 2 cm
de margen tridimensional, o a aquellos rodeados por una fascia intacta. La
linfadenectomía terapéutica sólo se indica cuando hay metástasis ganglionares
obvias o demostradas. Se recomienda linfadenectomía electiva sólo para los
casos raros de sarcomas epitelioides.16
Los grandes defectos tisulares pueden
reconstruirse con colgajos miocutáneos pediculados o libres. Los vasos
resecados pueden sustituirse con autoinjertos venosos o materiales sintéticos.
Los individuos que resultan con un déficit neurológico significativo después de
la resección de un nervio importante (p. ej., el nervio ciático) pueden
tratarse con ortesis. Los nervios menores pueden beneficiarse con injertos; el
éxito de este procedimiento depende de la edad del paciente y la longitud
resecada. El hueso puede sustituirse con injertos de cadáver o colgajos
microanastomosados. La amputación del miembro debe considerarse cuando sea la
preferencia del paciente y el tumor reúna algunas de las siguientes
características: compromiso extenso de la piel y tumores de gran volumen,
afectación de un nervio o arteria mayor, afectación ósea extensa que implique
resección extensa del hueso, falla a quimio o radioterapia preoperatoria o
recaída tumoral después de radioterapia coadyuvante. Los tumores voluminosos
requieren tratamiento multidisciplinario que combine una intervención
quirúrgica y radioterapia, aunque en fechas recientes se ha ensayado la
quimioterapia pre o posoperatoria. La operación elimina el tumor macroscópico y
la radioterapia esteriliza la enfermedad microscópica residual, lo que ofrece
un adecuado control local y mejores resultados funcionales. Sarcomas en el retroperitoneo Estos sarcomas suelen alcanzar grandes volúmenes e infiltrar
múltiples órganos y estructuras vitales antes de ser diagnosticados. En ellos,
la quimioterapia y la radioterapia tienen poco que ofrecer. El cirujano debe
obtener el margen más amplio y no dudar en resecar o remover órganos adyacentes
para obtener márgenes claros. La resecabilidad no guarda relación directa con
el tamaño tumoral, aunque ciertos factores im estructuras vasculares; es el
caso, por ejemplo, de la raíz del mesenterio, la presencia de sarcomatosis del
peritoneo, la invasión extensa de raíces nerviosas, la médula espinal y columna
vertebral, la invasión de la pared lateral de la pelvis, la presencia de
ascitis maligna y las metástasis a distancia. La resección completa suele ser
posible en 68 a 83% de los casos, con la remoción en bloque de las estructuras
o vísceras unidas a la neoplasia y potencialmente invadidas; las vísceras con
mayor involucro y que se incluyen durante la resección en bloque son riñón (32
a 46%), colon (25%), glándula suprarrenal (18%), páncreas (15%) y bazo (10%). Aunque
la invasión vascular puede ser un problema, la vena cava infrarenal puede
extraerse sin necesidad de reconstrucción debido al desarrollo de circulación
colateral, aunque lo ideal es tratar de hacer la reparación vascular con
injertos vasculares. Algunos estudios sugieren poco beneficio en términos de
sobrevida cuando se resecan estructuras vasculares o nerviosas mayores o hueso;
sin embargo, la resección completa se traduce en un mayor periodo libre de
enfermedad. En general, la morbilidad quirúrgica mayor va de 14 a 32% y la
mortalidad documentada es de 0 a 6%. La radioterapia externa no ha demostrado un
efecto contundente en la sobrevida o en el control locorregional, lo que se
debe a que la dosis es limitada por la tolerancia de los tejidos adyacentes (en
particular, intestino). Para obviar estas dificultades, se ha ensayado la radioterapia
intraoperatoria seguida de radioterapia externa, con resultados prometedores.
El grupo del Memorial
Sloan-Kettering Cancer Center observó
control local a 5 años de hasta 74 y 54% para tumores primarios y recurrentes, respectivamente.
La quimioterapia no ha demostrado efecto significativo, aunque se realizan ensayos
con la esperanza de obtener algún beneficio. La resección completa ofrece la
posibilidad de una sobrevida significativamente mayor a largo plazo (de 54% a cinco
años y de 45% a 10 años); por su parte, la sobrevida de los pacientes que se
someten a resección parcial (de 8 a 35% a cinco años) es apenas superior a la
que se observa en aquellos que sólo se sometieron a biopsia (0 a 15%).4,17-21 Sarcomas
en la pared abdominal El
problema quirúrgico de estos tumores no es la extensión de la resección sino la
reconstrucción. La reconstrucción de los planos fasciomusculares se hace con
malla sintética, pero en ocasiones se requieren colgajos. Los colgajos de mayor
uso son del recto anterior del abdomen y del tensor de la fascia lata. Los
defectos abdominales mayores suelen repararse con malla sintética, colgajo de
epiplón e injertos de piel de espesor parcial. Los tumores desmoides suelen ser
localmente agresivos y pueden causar la muerte. Con excepción de los pacientes
que se pueden observar de ma-piden la resección completa, como el compromiso de
nera segura, aquellos con márgenes positivos deben someterse a una nueva resección
si hay enfermedad macroscópica o a radiación si sólo hay enfermedad microscópica.
La radioterapia es una alternativa en el tratamiento primario de los tumores
desmoides irresecables y permite el control local en 80% de los pacientes que
reciben cuando menos 60 Gy en seis semanas. La respuesta parece ser mejor en
los tumores primarios que en los recurrentes; la regresión suele ser lenta y la
respuesta completa puede requerir varios años. Sarcomas en la pared torácica Las resecciones se ajustan a los principios ya descritos. En
las resecciones transmurales mayores es necesaria la reconstrucción para
obtener suficiente estabilidad de la pared torácica, que es vital para la
respiración. Las mallas de Marlex, Mersilene y Goretex se usan con éxito para
estabilizar el defecto torácico. La malla debe colocarse con tensión; para
incrementar la rigidez se usa un “sandwich” con Marlex y metilmetacrilato. Otros
materiales incluyen injertos de costilla y mallas de titanio. En casos de
grandes defectos tisulares se usan varios colgajos miocutáneos, como el colgajo
de dorsal ancho y recto anterior del abdomen. Además de éstos, se pueden cerrar
grandes defectos torácicos con el uso del epiplón cubierto con injertos
cutáneos de espesor parcial o colgajos libres microvasculares.3 Radioterapia
La radioterapia es un elemento de gran
importancia para el control local de los sarcomas de tejidos blandos, sobre
todo para los que se ubican en las extremidades. Se administra en la forma de
teleterapia, braquiterapia o una combinación de ambas. En la teleterapia las
radiaciones proceden de una fuente distante, mientras que en la braquiterapia
las fuentes de iridio 192 o yodo 125 se insertan en el lecho tumoral y emiten
una dosis alta de radiación que declina con rapidez en los tejidos sanos
adyacentes. La radioterapia puede emplearse de manera preoperatoria,
intraoperatoria y posoperatoria. La radioterapia preoperatoria se indica en
tumores de dudosa resecabilidad, para esterilizar la periferia del tumor, en un
intento por conservar una extremidad funcional mediante una operación limitada.
De esta manera se obtiene control local hasta en 90% de los casos y la
supervivencia libre de enfermedad alcanza 60 a 70%. La radioterapia
posoperatoria elimina la enfermedad subclínica residual y está indicada en los
casos restantes. Esta modalidad permite el control local y en 85% de los casos
se relaciona con preservación de una extremidad funcional. La dosis de
radioterapia con márgenes negativos es de 60 Gy; las dosis mayores sólo
aumentan el riesgo de complicaciones. La operación subóptima con margen
positivo, aun microscópico, se relaciona con riesgo importante de recaída, a
pesar de la administración de radioterapia.22
La braquiterapia intraoperatoria más la
escisión completa del tumor produce mejor control local (87 contra 67%) que la
operación aislada. El beneficio es evidente en los sarcomas de alto grado (90
comparado con 65%), pero nulo en los sarcomas de bajo grado.14 La utilidad de
la radioterapia en abdomen y retroperitoneo está limitada por las grandes
dimensiones típicas de estas neoplasias, lo que determina que órganos como el
intestino, riñón y médula espinal se encuentren dentro del volumen del
tratamiento, la explicación es la administración de dosis limitadas. Por otro
lado, la teleterapia en dosis > 35 Gy después de la escisión macroscópica
mejora el periodo libre de enfermedad. En casos seleccionados, la radioterapia
preoperatoria seguida de resección y radioterapia intraoperatoria con haz de
electrones, a dosis de 10 a 20 Gy produce resultados alentadores pero aún tiene
carácter experimental. La morbilidad de la radioterapia varía en función del
volumen tratado, dosis total y sitio radiado. En las extremidades incluye
edema, fibrosis, movilidad limitada y, con menos frecuencia, dolor, fracturas y
segundos tumores primarios. Puede causar deterioro de la cicatrización. En el
retroperitoneo, la morbilidad incluye enteritis y obstrucción intestinal. Una
consecuencia de la radioterapia intraoperatoria puede ser la neuropatía
periférica.23,24 Quimioterapia El aspecto más amenazante de la vida es la recaída sistémica.
La quimioterapia neoadyuvante
es útil en el tratamiento del sarcoma de
Ewing/tumor neuroectodérmico primitivo y rabdomiosarcoma. La quimioterapia está
indicada en estos casos, incluso cuando el tumor primario ha sido extirpado. En
otros tipos histológicos, la quimioterapia neoadyuvante basada en antraciclinas
e ifosfamida puede estar justificada en pacientes seleccionados con cuidado con
tumores grandes y de alto grado para preservar el órgano al reducir el volumen
tumoral. Los beneficios incluyen mejor control local, pero sólo un beneficio
marginal en el control de la enfermedad sistémica. En este contexto, la
quimioterapia debe usarse con una valoración juiciosa previa y bajo protocolos
con fines de investigación o como paliación. La quimioterapia en los sarcomas
metastásicos es objeto de controversia. Por el momento, sólo representa un
tratamiento paliativo.13,25,26 Recaídas
locales Sarcomas
de las extremidades Del total
de las recaídas locales, 80% ocurre antes de dos años y 100% antes de tres
años. Las observaciones más consistentes señalan que los enfermos con recaída
local tienen una sobrevida menor y con frecuencia relacionada con una recaída
sistémica. En casos seleccionados de recaída aislada, el enfermo es candidato a
tratamiento quirúrgico agresivo e incluso rerradiación, ya sea en forma de
braquiterapia o bien intraoperatoria, lo que en ocasiones favorece una
sobrevida satisfactoria. En casos seleccionados se ha ensayado la perfusión aislada
de la extremidad con melfalán y factor de necrosis tumoral, pero aún no se
cuenta con resultados concluyentes.11,26,27
Sarcomas del retroperitoneo La recaída local puede resecarse varias veces; esto es en
particular cierto para los sarcomas de bajo grado, para los que la resección
prolonga la sobrevida y el periodo libre de enfermedad. La resecabilidad en
laparotomías subsecuentes puede alcanzar 44%. Aun cuando la resección completa
no sea posible, se deberá considerar la resección parcial porque puede conducir
a una paliación adecuada. Recaídas
sistémicas Los pacientes
con sarcomas de alto grado presentan recaídas sistémicas hasta en 40% de los
casos; éstas representan la causa más común de muerte. La mayoría de las
recaídas a distancia ocurre dentro de los 24 meses del tratamiento inicial; los
sitios más comunes son pulmones, hueso, hígado y cerebro. En presencia de
metástasis pulmonares aisladas, la supervivencia a 5 años provocada por la
resección quirúrgica es de 15 a 20% una vez que el tumor primario esté
controlado. Si la recaída ocurre después de un año del tratamiento inicial y el
número de metástasis es inferior a cuatro, el control a cinco años se eleva a
50%.15,18 Resultados
del tratamiento En pacientes
con sarcomas retroperitoneales se puede realizar resección completa en 38 a 65%
de los casos; la recaída local alcanza 54% a cinco años y 90% a 10 años. El
periodo libre de enfermedad a cinco años alcanza 22 y 50% si sólo se incluyen
los pacientes con tumores resecados por completo. La sobrevida global a dos,
cinco y 10 años es de 56, 34 y 8%, respectivamente. La sobrevida a cinco años
en casos con resección completa es de 70%, en contraste con 8% en casos de
resección parcial o biopsia. No suele haber diferencias importantes en la
sobrevida en cuanto al tipo histológico, pero el grado sí tiene importancia en
el pronóstico: la supervivencia media es de 46 a 80 meses en los casos con
tumores de bajo grado, en comparación con 18 a 20 meses en los casos de tumores
de alto grado. Seguimiento La
recaída en pacientes con sarcomas de extremidades ocurre con mayor frecuencia en
los primeros 24 meses (80 a 90%). El examen físico cuidadoso, con énfasis en el
sitio del tumor primario se practica cada tres meses. Se realiza radiografía de
tórax posteroanterior y lateral cada seis meses. En caso de nódulo sospechoso o
en sarcomas de alto grado, se solicita TC para evaluar metástasis pulmonares; en
caso de evaluación clínica difícil, se recomienda TC o IRM del lecho quirúrgico
cada 6 meses. Como parte del seguimiento, del tercer al quinto año se practica
un examen físico cuidadoso cada seis meses que incluye radiografía de tórax posteroanterior
y lateral y TC o IRM del lecho quirúrgico (en caso de que se sospeche actividad
tumoral). A partir del quinto año se practica un examen físico anual con
radiografía de tórax posteroanterior y lateral. Los pacientes con sarcomas del
retroperitoneo deben someterse a exploración clínica y exámenes de laboratorio
pertinentes, entre los que se incluyen PFH y radiografía de tórax
posteroanterior y lateral cada 3 meses durante los dos primeros años, luego
cada seis meses hasta cumplir cinco años y después cada año. La presencia de
alguna manifestación abdominal amerita TC; de lo contrario, ésta se solicita
cada seis meses.25 66. Sarcomas de tejidos blandos en tronco y
extremidades 949
Billingsley KG, Lewis JJ, Leung DH, et al. Multifactorial
analysis of the sur-
vival of patients with
distant metastasis arising from primary extremity
sarcoma. Cancer 1999;85:389-395.
Gardner TE, Daly JM. Part II: diagnosis and management of
distant recu-
rrence in soft tissue
sarcomas. Sem Oncol 1993;20:456-461.
Keus RB, Rutgers EJ, Ho GH,
et al. Limb-sparing therapy of extremity soft
tissue sarcomas: treatment
outcome and long-term functional results.
Eur J Cancer
1994;30A:1459-1463.
Stojadinovic A, Leung DH,
Hoos A, et al. Analysis of the prognostic signi-
ficance of microscopic
margins in 2,084 localized primary adult soft
tissue sarcomas. Ann Surg
2002;235:424-434.
Trovik CS, Bauer HC,
Alvegard TA, et al. Surgical margins, local recurren-
ce and metastases in soft
tissue sarcomas: 559 surgically treated pa-
tients from the
Scandinavian Sarcoma Group Register. Eur J Cancer
2000;36:710-716.
Zagars GK, Ballo MT,
Pisters PW, et al. Prognostic factors for patients with
localized soft-tissue
sarcoma treated with conservation surgery and
radiation therapy: an
analysis of 225 patients. Cancer
2003;97:2530-
2543.


