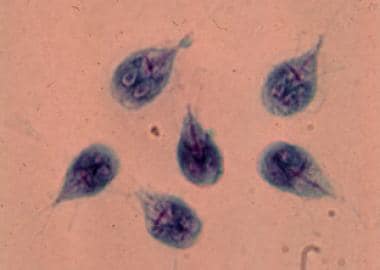
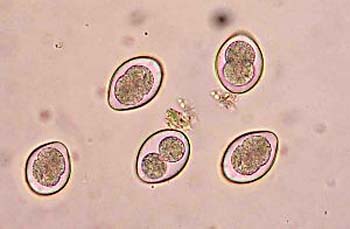
COCCIDIOSIS
(criptosporidiosis, isosporosis, ciclosporosis, sarcocistosis) Y
MICROSPORIDIOSIS
Diarrea aguda,
sobre todo en niños en países en desarrollo. _ Brotes de diarrea causados por agua o alimentos contaminados. _ Diarrea prolongada en personas
con inmunodepresión. _ El diagnóstico casi siempre se establece mediante la identificación
de microorganismos en muestras fecales con tinción especial
Generalidades
Los causantes de
las coccidiosis son microorganismos delgénero Cryptosporidium (C.
parvum, C. hominis y otras), Isospora belli, Cyclospora cayetanensis y
del género Sarcocystis. Al menos 14 especies producen microsporidiosis,
las más frecuentes de las cuales son Enterocytozoon bieneusi y Encephalitozoon
intestinalis.
Estas
parasitosis ocurren en todo el mundo, sobre todo en los trópicos y las regiones
con situaciones higiénicas deficientes. Son causa de gastroenteritis infantil
endémica (en particular en niños desnutridos de países en desarrollo), brotes
hospitalarios y comunitarios de diarrea, diarrea del viajero y diarrea aguda y
crónica en pacientes inmunodeprimidos, en especial aquellos con sida. Son
notables por la capacidad para causar diarrea prolongada, a menudo por varias
semanas. Se observa acumulación de casos en viviendas, guarderías y entre
parejas sexuales.
Los agentes
infecciosos son ooquistes (coccidiosis) o esporas (microsporidiosis) que se
transmiten de una persona a otra, al nadar en agua contaminada o mediante la
ingestión de agua o alimento contaminados. Los ooquistes ingeridos liberan
esporozoítos que invaden y se multiplican en los enterocitos, sobre todo en el
intestino delgado. Los ooquistes de coccidios y los quistes de microsporidios
permanecen viables en el ambiente por años. Isospora belli y C.
cayetanensis parecen infectar sólo a seres humanos.
En Estados
Unidos, C. cayetanensis ha producido en años recientes varios brotes por
alimentos, casi siempre relacionados con productos frescos importados. Sarcocystis
infecta a muchas especies; los seres humanos son hospedadores intermedios (infectados
por la ingestión de esporoquistes fecales) para algunas especies, pero son
hospedadores definitivos para Sarcocystis bovihominis y Sarcocystis
suihominis (infectados por la ingestión de quistes hísticos en carne mal
cocinada de res y cerdo, respectivamente). La criptosporidiosis es una zoonosis
(C. parvum infecta en particular al ganado), pero la mayor parte de las
parasitosis humanas se adquiere de otras personas, en especial por C.
hominis.
Los
criptosporidios son muy infecciosos y se transmiten con facilidad en guarderías
y viviendas. Han ocasionado grandes brotes comunitarios por contaminación de
suministros de agua (representaron casi 400 000 casos en Milwaukee en 1993) y
constituyen la principal causa de brotes de gastroenteritis relacionados con agua
en situaciones recreativas. Es importante señalar que los coccidios y los
microsporidios casi siempre pasan inadvertidos en los análisis
coproparasitoscópicos, ya que se requieren técnicas de tinción especiales para
identificarlos.
Manifestaciones
clínicas A. Signos y síntomas
Criptosporidiosis. Al parecer, el periodo de incubación es de uno a 14 días. En
países en vía de desarrollo, la enfermedad se presenta sobre todo en niños
menores de cinco años de edad, en los que la criptosporidiosis causa 5 a 10% de
los casos de diarrea infantil. Los síntomas iniciales en niños incluyen diarrea
acuosa aguda, dolor abdominal y cólicos, con curación rápida en la mayor parte
de los casos. Sin embargo, muy a menudo los síntomas persisten por dos semanas
o más.
En las naciones desarrolladas, casi todos los
pacientes afectados son adultos. La diarrea en sujetos con buena respuesta
inmunitaria suele durar cinco a 10 días. Por lo general es acuosa, acompañada
de dolor y cólicos abdominales, náusea, vómito y fiebre. Puede haber
recurrencias después de la eliminación inicial de los síntomas. También son
frecuentes las enfermedades leves y la infección asintomática.
La
criptosporidiosis es una causa bien identificada de diarrea en los enfermos con
sida. Era frecuente en esta población antes del advenimiento del tratamiento
antirretroviral altamente activo, sobre todo en los sujetos con inmunodepresión
avanzada. Las manifestaciones clínicas son variables, pero los pacientes tienen
con frecuencia diarrea crónica con evacuaciones repetidas fétidas, malabsorción
y pérdida de peso. Es posible que haya diarrea acuosa intensa que ponga en
peligro la vida. La criptosporidiosis también provoca enfermedad
extraintestinal en el sida, incluidos infiltrados pulmonares con disnea e
infección biliar con colangitis esclerosante y colangiopatía por sida.
. Isosporosis
(isosporiasis). El periodo de incubación para I.
belli es cercano a una semana. En personas con buena respuesta inmunitaria,
produce casi siempre diarrea acuosa que desaparece de forma espontánea y que
dura dos a tres semanas, con cólicos abdominales, anorexia, malestar y pérdida
de peso. La fiebre es poco común. Es probable que los síntomas crónicos
persistan durante meses en algunos individuos. En los enfermos
inmunodeprimidos, muchas veces la isosporosis ocasiona diarrea grave y crónica,
con complicaciones que incluyen deshidratación marcada, desnutrición y colitis
hemorrágica. Hay informes escasos de enfermedad extraintestinal.
Ciclosporosis
(ciclosporiasis). Los ooquistes de C.
cayetanensis deben pasar por un periodo de esporulación de siete días o más
después de su expulsión para volverse infecciosos. Por consiguiente, es
improbable la diseminación de una persona a otra; por lo general, se debe a
agua y alimentos contaminados (en especial productos frescos).
El periodo de
incubación es de uno a 11 días. Las parasitosis pueden ser asintomáticas. La
ciclosporosis genera una enfermedad similar a la descrita para los otros
agentes patógenos incluidos en esta sección, con diarrea acuosa, cólicos
abdominales, náusea, fatiga y anorexia. En 25% de los casos hay fiebre.
Los síntomas típicos continúan por dos semanas
o más y pueden persistir por meses. Son habituales las recurrencias diarreicas.
Algunas veces, la diarrea va precedida por un pródromo seudogripal y luego
aparece fatiga persistente. En los sujetos con afectación inmunitaria, la
ciclosporosis suele ser más grave y prolongada, con diarrea acuosa fulminante
crónica y pérdida de peso.
Sarcocistosis. La infección por Sarcocystis es frecuente en algunos países
en desarrollo, pero casi siempre es asintomática. En apariencia, la infección
sigue a menudo a la ingestión de carne de res o cerdo mal cocida, lo cual
posibilita el desarrollo de los quistes en el músculo con mialgias, fiebre,
broncoespasmo, exantema pruriginoso, linfadenopatía y nódulos subcutáneos. La
ingestión de esporoquistes fecales puede causar síntomas digestivos.
Microsporidiosis. Los microsporidios son protozoarios intracelulares obligados que
producen un amplio espectro de enfermedades. Muchas infestaciones son de origen
zoonótico, pero está documentada la transmisión entre personas. La afectación
se origina en particular por ingestión de esporas, aunque también por
inoculación directa de los ojos. En los hospedadores con buena respuesta
inmunitaria, las infecciones por microsporidios casi siempre se manifiestan con
diarrea autolimitada. Además, se han descrito infecciones oculares. La
enfermedad por microsporidios se presenta sobre todo en personas con
inmunodepresión, en especial aquellas con sida. Con mayor frecuencia, las
parasitosis en pacientes con sida se deben a E. bieneusi y E.
intestinalis; causan diarrea crónica, con anorexia, distensión, pérdida de
peso y emaciación, sobre todo en sujetos con inmunodeficiencia avanzada. Casi
nunca hay fiebre. Otros padecimientos relacionados con microsporidios
(incluidos los géneros Enterocytozoon, Encephalitozoon, Brachiola, Vittaforma,
Pleistophora, Trachipleistophora y Microsporidium) en personas con
inmunodepresión incluyen afectación de las vías biliares (colangiopatía del
sida), infección genitourinaria con cistitis, nefropatía, hepatitis,
peritonitis, miositis, infecciones respiratorias que abarcan sinusitis, así
como infecciones del sistema nervioso central que incluyen encefalitis
granulomatosa e infecciones diseminadas. Las afectaciones oculares por
microorganismos del género Encephalitozoon provocan conjuntivitis y
queratitis, las cuales se manifiestan con hiperemia, fotofobia y pérdida de
agudeza visual.
Datos de
laboratorio
Criptosporidiosis. Por lo general, las heces no tienen sangre ni leucocitos. La
manera tradicional de establecer el diagnóstico consiste en una tinción
acidorresistente modificada; esta técnica es relativamente insensible y deben
analizarse múltiples muestras antes de descartar el diagnóstico. Es notable que
el estudio habitual en busca de huevos y parásitos no incluya una tinción
acidoresistente modificada, por lo que en muchos laboratorios debe solicitarse
de manera específica. La detección de antígeno ofrece mejores sensibilidad y
especificidad, ambas superiores a 90% con varios análisis disponibles; en el
presente, estos métodos pueden considerarse el instrumento diagnóstico óptimo. 2.
Isosporosis. El diagnóstico de isosporosis se establece por análisis fecal
en fresco o después de tinción acidorresistente modificada, en la cual el
microorganismo se distingue con claridad de otros parásitos. Otras tinciones
también muestran al agente patógeno. La diseminación de ooquistes puede ser
intermitente, por lo cual la sensibilidad de la prueba fecal no es alta y deben
examinarse múltiples muestras. El microorganismo también puede identificarse en
aspirados duodenales o biopsias del intestino delgado.
Ciclosporosis. El diagnóstico se establece con la valoración de preparaciones
húmedas fecales o después de la tinción acidorresistente modificada. Algunas
veces es necesario analizar múltiples muestras para precisar el diagnóstico. El
microorganismo también puede identificarse en aspirados del intestino delgado o
muestras de biopsia.
Sarcocistosis. Es probable encontrar eosinofilia y aumento de la creatina cinasa.
El diagnóstico se establece por identificación de los agentes patógenos
acidorresistentes en las heces o por detección de trofozoítos o bradizoítos en
biopsias de tejido.
Microsporidiosis. El diagnóstico puede establecerse por identificación de los
microorganismos en una muestra de heces, líquido o tejido con tinción especial,
como la tinción con base cromótropa de Weber. La microscopia electrónica ayuda
a confirmar el diagnóstico y la identificación por especie. Se dispone de
técnicas para PCR y cultivo, pero no se usan de manera regular. _
Tratamiento
La mayor parte
de las infecciones agudas con estos microorganismos patógenos en personas con
buena respuesta inmunitaria se autolimita y no requiere tratamiento.
El tratamiento
de sostén para diarrea grave o crónica incluye reposición de líquidos y
electrólitos y, en algunos casos, nutrición parenteral.
1. Criptosporidiosis. El tratamiento
de este padecimiento es un desafío. No se cuenta con algún fármaco por completo
eficaz. Se han observado beneficios leves en algunos estudios (pero no en
otros) con paromomicina, un aminoglucósido que no se absorbe (se ha usado en
dosis de 25 a 35 mg/kg vía oral por 14 días) y nitazoxanida (500 mg a 1 g por
vía oral dos veces al día por tres días en sujetos sin inmunodepresión y por
dos a ocho semanas en pacientes con sida avanzado), un esquema terapéutico
aprobado en Estados Unidos para esta infección. Quizás haya efectos tóxicos
digestivos menores. Otros fármacos que se han administrado con éxito
inconstante en individuos con sida y criptosporidiosis son azitromicina,
espiramicina, calostro hiperinmunitario bovino y octreótido. Lo más importante
es revertir la inmunodeficiencia con tratamiento antirretroviral efectivo.
Isosporosis. El tratamiento eficaz para la isosporosis en pacientes con buena
respuesta inmunitaria e inmunodeprimidos incluye trimetoprim-sulfametoxazol
(160 mg/800 mg dos a cuatro veces al día por 10 días, con dosis más altas en
pacientes con sida). Una alternativa terapéutica es la pirimetamina (75 mg
divididos en cuatro dosis) con ácido folínico (10 a 25 mg/día). El tratamiento
de sostén o apoyo con dosis bajas de trimetoprimsulfametoxazol (160 mg/800 mg
diarios o tres veces por semana) o sulfadoxina-pirimetamina (una tableta cada
semana) previene la recurrencia en los enfermos con inmunodepresión
persistente.
Ciclosporosis. Esta infección
también se trata con trimetoprim- sulfametoxazol (la misma dosis que en la
isosporosis). En el sida, el tratamiento de sostén o apoyo a largo plazo (160
mg/800 mg tres veces a la semana) ayuda a prevenir la recurrencia. En pacientes
que no toleran el trimetoprim-sulfametoxazol, la ciprofloxacina (500 mg por vía
oral dos veces al día por siete días) resultó eficaz, aunque con menor
capacidad de eliminar el microorganismo respecto del
trimetoprim-sulfametoxazol.
Sarcocistosis. No existe un
tratamiento específico para esta entidad patológica, pero en un estudio se
observó que la sulfadiazina eliminó los quistes intestinales.
Microsporidiosis. El tratamiento de la microsporidiosis es complejo. Las infecciones
con la mayor parte de las especies, incluidas las que producen manifestaciones
gastrointestinales y de otro tipo, deben tratarse con albendazol (400 mg orales
dos veces al día por dos a cuatro semanas), el cual tiene actividad contra
varias especies, pero su eficacia es relativamente baja (alrededor de 50%)
contra E. bieneusi, la causa más frecuente de diarrea en sujetos con
sida. La fumagilina, que se prescribe en el tratamiento de abejas y peces con
infecciones por microsporidios, ha sido beneficiosa en los estudios clínicos en
dosis de 20 mg tres veces al día durante 14 días; el tratamiento se acompañó de
trombocitopenia reversible. Como ocurre con la criptosporidiosis, la mejor
forma de controlar la microsporidiosis en pacientes con sida consiste en
restaurar la función inmunitaria con antirretrovirales efectivos.
La microsporidiosis ocular puede tratarse con solución de
fumagilina (3 mg/ml); es probable que deba aplicarse al mismo tiempo que el
albendazol sistémico. El tratamiento adjunto puede incluir corticoesteroides
para disminuir la inflamación y la queratoplastia. _
Prevención
La purificación del agua es importante para controlar estas
infecciones. La desinfección con cloro es inútil contra los ooquistes de
criptosporidios, por lo cual se requieren otras medidas de purificación. Los
pacientes inmunodeprimidos deben hervir o filtrar el agua para beber y tal vez
deban evitar lagos y piscinas. Las precauciones habituales (lavado de manos,
guantes, desinfección) deben prevenir la diseminación institucional de un
paciente a otro. No se conocen bien las medidas óptimas para prevenir las
parasitosis por microsporidios, pero es probable que sean efectivas la
purificación de agua, como se explicó antes, y las precauciones con sustancias
corporales para personas con inmunodepresión y hospitalizadas.